高中化学竞赛/价层电子对互斥模型
我们已在高中初步学习了价层电子对互斥模型,并且了解了价层电子对数的计算公式(a为中心原子的族序数,b为配位原子达到稳定结构需要的电子数,x为配位原子的数量)。在这里我们会学习一种新的判断VSEPR模型的方法。
对于以A原子为中心原子的某一分子(或离子)AXn,我们将其写为AXnEm,E表示中心原子A上的孤对电子对数。那么有:
其中a为A的族序数,b为X的化合价,q为离子所带电荷数(带正负号)。
Template:例题我们令,便可写出AYz这个通式。这里的z表示价层电子对数。这样,我们便可以与高中阶段联系起来了。
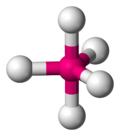
z与VSEPR模型对应关系如下表:
| z | 2 | 3 | 4 | 5 | 6 |
| VSEPR模型 | 直线型 | 平面三角形 | 正四面体型 | 三角双锥型 | 正八面体型 |
| 球棍模型 | 
|

|
|

|
我们舍去孤对电子,便得到了粒子的实际构型。但孤对电子实际位置需要通过下列几种斥力顺序判断:
- 孤对电子对-孤对电子对>孤对电子对-键合电子对>键合电子对-键合电子对
- 双键-单键>单键-单键
- 电负性弱-电负性弱>电负性弱-电负性强>电负性强-电负性强
Template:例题 一般来讲,确定了z、m之后,分子构型如下表所示:
| 电子对数 | m=0 | m=1 | m=2 | m=3 |
|---|---|---|---|---|
| 2 | ||||
| 3 | 
|

|
||
| 4 | 
|

|

|
|
| 5 | 
|

|

|

|
| 6 | 
|

|

|
T型 |